Οι νόμοι του Faraday για την ηλεκτρόλυση
Οι νόμοι της ηλεκτρόλυσης του Faraday είναι ποσοτικές σχέσεις που βασίζονται στην ηλεκτροχημική έρευνα του Michael Faraday, την οποία δημοσίευσε το 1836.
Αυτοί οι νόμοι καθορίζουν τη σχέση μεταξύ της ποσότητας των ουσιών που απελευθερώνονται κατά την ηλεκτρόλυση και την ποσότητα ηλεκτρικής ενέργειας που διέρχεται από τον ηλεκτρολύτη. Οι νόμοι του Faraday είναι δύο. Στην επιστημονική βιβλιογραφία και στα σχολικά βιβλία, υπάρχουν διαφορετικές διατυπώσεις αυτών των νόμων.
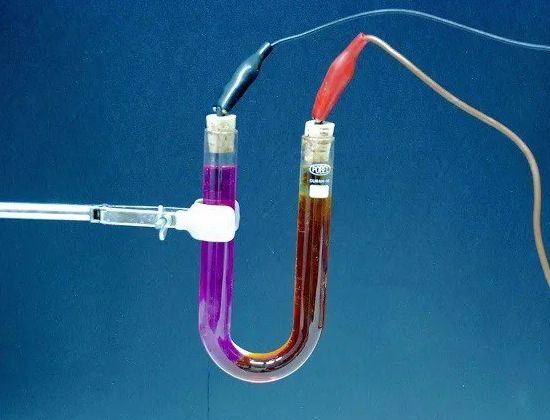
Ηλεκτρόλυση — απελευθέρωση από τον ηλεκτρολύτη των συστατικών του ουσιών κατά τη διέλευση ηλεκτρική ενέργεια… Για παράδειγμα, όταν ένα ηλεκτρικό ρεύμα διέρχεται από ελαφρώς οξινισμένο νερό, το νερό αποσυντίθεται στα συστατικά του μέρη — αέρια (οξυγόνο και υδρογόνο).
Η ποσότητα της ουσίας που απελευθερώνεται από τον ηλεκτρολύτη είναι ανάλογη με την ποσότητα ηλεκτρικής ενέργειας που διέρχεται από τον ηλεκτρολύτη, δηλαδή το γινόμενο της ισχύος του ρεύματος επί το χρόνο κατά τον οποίο ρέει αυτό το ρεύμα. Επομένως, το φαινόμενο της ηλεκτρόλυσης μπορεί να χρησιμεύσει για τη μέτρηση της ισχύος του ρεύματος και τον προσδιορισμό τρέχουσες μονάδες.
Ηλεκτρολύτης — ένα διάλυμα και γενικά ένα σύνθετο υγρό που μεταφέρει ηλεκτρικό ρεύμα.Στις μπαταρίες, ο ηλεκτρολύτης είναι ένα διάλυμα θειικού οξέος (σε μόλυβδο) ή ένα διάλυμα καυστικής ποτάσας ή καυστικής σόδας (σε σίδηρο-νικέλιο). Στα γαλβανικά κύτταρα, διαλύματα οποιωνδήποτε χημικών ενώσεων (αμμωνία, θειικός χαλκός κ.λπ.) χρησιμεύουν επίσης ως ηλεκτρολύτης.
Michael Faraday (1791 - 1867)
Michael Faraday (1791 — 1867) — Άγγλος φυσικός, ιδρυτής του σύγχρονου δόγματος των ηλεκτρομαγνητικών φαινομένων. Ξεκίνησε την επαγγελματική του ζωή ως μαθητευόμενος σε εργαστήριο βιβλιοδεσίας. Έλαβε μόνο μια στοιχειώδη εκπαίδευση, αλλά σπούδασε ανεξάρτητα επιστήμες και εργάστηκε ως βοηθός εργαστηρίου για τον χημικό Devi, έγινε μεγάλος επιστήμονας, ένας από τους μεγαλύτερους πειραματικούς φυσικούς.
Ο Φάραντεϊ άνοιξε φαινόμενο ηλεκτρομαγνητικής επαγωγής, οι νόμοι της ηλεκτρόλυσης, ανέπτυξαν το δόγμα των ηλεκτρικών και μαγνητικών πεδίων και έθεσαν θεμέλια των σύγχρονων εννοιών του ηλεκτρομαγνητικού πεδίου… Ήταν ο πρώτος επιστήμονας που είχε την ιδέα της δονητικής, κυματικής φύσης των ηλεκτρομαγνητικών φαινομένων.
Ο πρώτος νόμος του Faraday για την ηλεκτρόλυση
Η μάζα μιας ουσίας που θα καταβυθιστεί σε ένα ηλεκτρόδιο κατά τη διάρκεια της ηλεκτρόλυσης είναι ευθέως ανάλογη με την ποσότητα ηλεκτρικής ενέργειας που μεταφέρεται σε αυτό το ηλεκτρόδιο (που διέρχεται από τον ηλεκτρολύτη). Η ποσότητα ηλεκτρικής ενέργειας αναφέρεται στην ποσότητα του ηλεκτρικού φορτίου, που συνήθως μετριέται σε μενταγιόν.
Ο δεύτερος νόμος του Faraday για την ηλεκτρόλυση
Για μια δεδομένη ποσότητα ηλεκτρικής ενέργειας (ηλεκτρικό φορτίο), η μάζα ενός χημικού στοιχείου που θα εναποτεθεί σε ένα ηλεκτρόδιο κατά την ηλεκτρόλυση είναι ευθέως ανάλογη με την ισοδύναμη μάζα αυτού του στοιχείου. Η ισοδύναμη μάζα μιας ουσίας είναι η μοριακή της μάζα διαιρούμενη με έναν ακέραιο αριθμό, ανάλογα με τη χημική αντίδραση στην οποία εμπλέκεται η ουσία.
Ή
Η ίδια ποσότητα ηλεκτρικής ενέργειας οδηγεί στην απελευθέρωση ισοδύναμων μαζών διαφορετικών ουσιών στα ηλεκτρόδια κατά την ηλεκτρόλυση. Για να ελευθερωθεί ένα mole ισοδύναμου οποιασδήποτε ουσίας, είναι απαραίτητο να δαπανηθεί η ίδια ποσότητα ηλεκτρικής ενέργειας, δηλαδή 96485 C. Αυτή η ηλεκτροχημική σταθερά ονομάζεται Αριθμός Faraday.
Οι νόμοι του Faraday σε μαθηματική μορφή
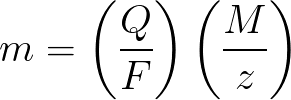
-
m είναι η μάζα της ουσίας που εναποτίθεται στο ηλεκτρόδιο.
-
Q είναι η τιμή του συνολικού ηλεκτρικού φορτίου στα μενταγιόν, που διέρχεται κατά την ηλεκτρόλυση.
-
F = 96485,33 (83) C / mol — αριθμός Faraday.
-
M είναι η μοριακή μάζα του στοιχείου σε g/mol.
-
z — αριθμός σθένους των ιόντων μιας ουσίας (ηλεκτρόνια ανά ιόν).
-
M / z — ισοδύναμη μάζα της ουσίας που εφαρμόζεται στο ηλεκτρόδιο.
Εφαρμόζοντας στον πρώτο νόμο της ηλεκτρόλυσης του Faraday, τα M, F και z είναι σταθερές, επομένως όσο περισσότερο Q, τόσο περισσότερο θα είναι το m.
Όσον αφορά τον δεύτερο νόμο της ηλεκτρόλυσης του Faraday, τα Q, F και z είναι σταθερές, επομένως όσο περισσότερα M / z, τόσο περισσότερα m θα είναι.
Για συνεχές ρεύμα έχουμε
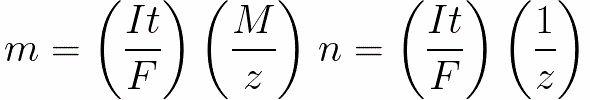
-
n είναι ο αριθμός των mol (ποσότητα ουσίας) που απελευθερώνονται στο ηλεκτρόδιο: n = m / M.
-
t είναι ο χρόνος διέλευσης συνεχούς ρεύματος από τον ηλεκτρολύτη. Για εναλλασσόμενο ρεύμα, η συνολική φόρτιση αθροίζεται με την πάροδο του χρόνου.
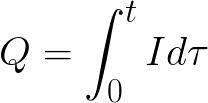
-
t είναι ο συνολικός χρόνος ηλεκτρόλυσης.
Ένα παράδειγμα εφαρμογής των νόμων του Faraday
Είναι απαραίτητο να γραφτεί η εξίσωση των ηλεκτροχημικών διεργασιών στην κάθοδο και την άνοδο κατά την ηλεκτρόλυση ενός υδατικού διαλύματος θειικού νατρίου με μια αδρανή άνοδο. Η λύση στο πρόβλημα θα είναι η εξής. Σε διάλυμα, το θειικό νάτριο θα διασπαστεί σύμφωνα με το ακόλουθο σχήμα:
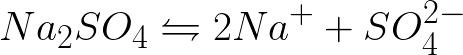
Το τυπικό δυναμικό ηλεκτροδίου σε αυτό το σύστημα έχει ως εξής:
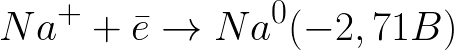
Αυτό είναι ένα πολύ πιο αρνητικό επίπεδο δυναμικού από ό,τι για ένα ηλεκτρόδιο υδρογόνου σε ουδέτερο μέσο (-0,41 V). Επομένως, στο αρνητικό ηλεκτρόδιο (κάθοδος), η ηλεκτροχημική διάσταση του νερού θα ξεκινήσει με την απελευθέρωση υδρογόνου και ιόντος υδροξειδίου σύμφωνα με το ακόλουθο σχήμα:
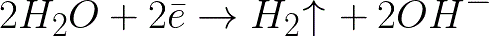
Και τα θετικά φορτισμένα ιόντα νατρίου που πλησιάζουν την αρνητικά φορτισμένη κάθοδο θα συσσωρευτούν κοντά στην κάθοδο, στο διπλανό μέρος του διαλύματος.
Η ηλεκτροχημική οξείδωση του νερού θα συμβεί στο θετικό ηλεκτρόδιο (άνοδος), η οποία θα οδηγήσει στην απελευθέρωση οξυγόνου, σύμφωνα με το ακόλουθο σχήμα:
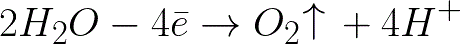
Σε αυτό το σύστημα, το τυπικό δυναμικό ηλεκτροδίου είναι +1,23 V, το οποίο είναι πολύ χαμηλότερο από το τυπικό δυναμικό ηλεκτροδίου που βρίσκεται στο ακόλουθο σύστημα:
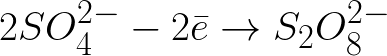
Τα αρνητικά φορτισμένα θειικά ιόντα που κινούνται προς τη θετικά φορτισμένη άνοδο θα συσσωρευτούν στον χώρο κοντά στην άνοδο.

